- English
- 日本語
- 한국어
- Deutsch
- Français
- Español
No data
官方服务号
招聘公众号
 针对制约细胞与基因治疗行业发展的诸如GMP核心原料质量波动、供应链脆弱及法规不确定性等难题,GMP品牌Resilient Supply,意在为全球客户带来更具灵活韧性、更低风险、更高品质且更专业支持的解决方案,加速CGT生物药研发上市进程。
针对制约细胞与基因治疗行业发展的诸如GMP核心原料质量波动、供应链脆弱及法规不确定性等难题,GMP品牌Resilient Supply,意在为全球客户带来更具灵活韧性、更低风险、更高品质且更专业支持的解决方案,加速CGT生物药研发上市进程。
![]() 经ISO 9001:2015 和 ISO 13485:2016认证
经ISO 9001:2015 和 ISO 13485:2016认证
![]() 生产厂房具备药品生产许可证
生产厂房具备药品生产许可证
![]() 药品B+A级洁净室和自动灌装设备
药品B+A级洁净室和自动灌装设备
![]() 无菌技术与二级除菌过滤
无菌技术与二级除菌过滤
![]() 完整的批生产和检验记录
完整的批生产和检验记录
![]() 设备维护和校准程序
设备维护和校准程序
![]() 无动物源性材料和生产环境
无动物源性材料和生产环境
![]() 人员培训体系
人员培训体系
![]() 供应商和原材料管理体系
供应商和原材料管理体系
![]() 质量文件/记录经QA审查和批准
质量文件/记录经QA审查和批准
![]() 分析方法的验证
分析方法的验证
![]() 完整的法规支持文档(RSF)
完整的法规支持文档(RSF)
![]() 细胞活性高于0.8 x 107 IU/mg
细胞活性高于0.8 x 107 IU/mg
![]() 纯度高于95%
纯度高于95%
![]() 内毒素低于10EU/mg
内毒素低于10EU/mg
![]() 宿主DNA残留低于0.02ng/ug
宿主DNA残留低于0.02ng/ug
![]() 宿主蛋白残留低于0.5ng/ug
宿主蛋白残留低于0.5ng/ug
![]() 无菌检测
无菌检测
![]() 支原体检测
支原体检测
![]() 外源病毒检测
外源病毒检测
![]() 高批间一致性
高批间一致性
![]() 全面的稳定性数据支持(加速,冻融,长期,运输稳定性验证)
全面的稳定性数据支持(加速,冻融,长期,运输稳定性验证)
![]() 体内安全性数据
体内安全性数据
![]() 药典标准放行
药典标准放行
- 16项质量控制指标
- 更好的安全性(无菌,支原体,外源病毒,各项杂质残留检测)
- 高稳定性和批间一致性
![]() 更严格GMP质量管理体系
更严格GMP质量管理体系
- 药品级生产厂房
- 药用级物料/包材
- 支持线上/线下审计
![]() 加速临床/上市申报
加速临床/上市申报
- 完整的细胞/基因治疗产品申报支持文档
- 提供全套方法学验证报告
- 已完成FDA DMF备案
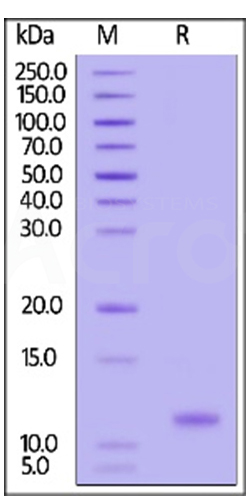
SDS-PACE 纯度>95%
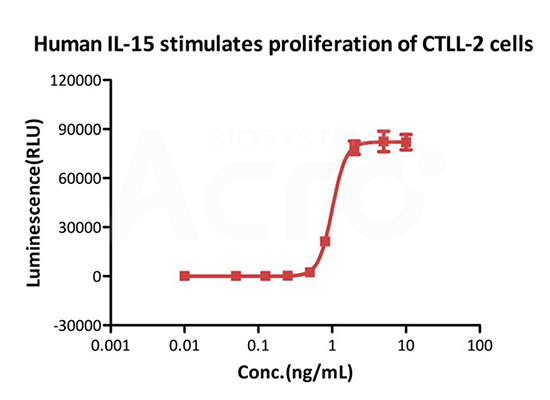
刺激CTLL-2 细胞增殖实验结果显示,GMP Human IL-15 (GMP-L15H13)的细胞活性高于0.8 ⅹ10^7 IU/mg(经WHO Human IL-15标品校准,NIBSC 代码:95/554)。