- English
- 日本語
- 한국어
- Deutsch
- Français
- Español
No data
官方服务号
招聘公众号
灭活疫苗/重组蛋白疫苗:SDS-PAGE,MS,ELISA;
病毒载体疫苗/核酸疫苗:Western Blot,FACS;
重组蛋白疫苗:ELISA,SPR,BLI
动物血清总抗体检测:间接法ELISA
①体内效力试验:
★体液免疫:
Ⅰ动物血清总抗体检测:间接法ELISA
Ⅱ动物血清中和抗体检测:cVNT,pVNT,sVNT(竞争法ELISA)
★细胞免疫:Elispot
②体外效价检测: 疫苗抗原含量:双抗夹心ELISA
③动物保护性试验:动物攻毒保护试验
①体液免疫(抗体亚型检测):间接法ELISA
②细胞免疫(特异性T细胞及细胞因子检测):Elispot
①体内效力试验:
★体液免疫:
Ⅰ人体血清总抗体检测:间接法ELISA
Ⅱ人体血清中和抗体检测:cVNT,pVNT,sVNT(竞争法ELISA)
★细胞免疫:Elispot
②体外效价检测:
★疫苗抗原含量:双抗夹心法ELISA
③动物保护性试验:动物攻毒保护试验
①体液免疫(抗体亚型检测):间接法ELISA
②细胞免疫(特异性T细胞及细胞因子检测):Elispot
①人体血清总抗体检测:间接法ELISA
②人体血清中和抗体检测:CVNT, pVNT, sVNT(竞争法ELISA)
SDS-PAGE及MS抗原检测的高纯度标品——天然Pre-fusion状态三聚体Spike蛋白
| 新冠种属 | 货号 | 突变位点 | 标签 | 订购/预购 |
|---|---|---|---|---|
| Gamma | P.1 | SPN-C52Hg | L18F, T20N, P26S, D138Y, R190S, K417T, E484K, N501Y, D614G, H655Y, T1027I, V1176F | His Tag | |
| Wild type | SPN-C52H9 |
|
His Tag |
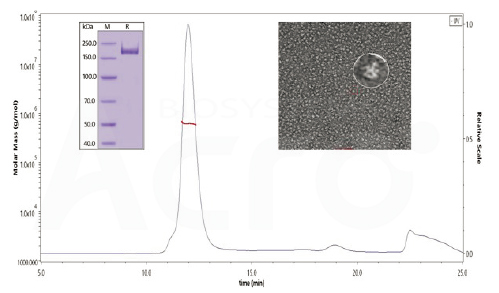
The purity of SARS-CoV-2 S protein, His Tag, Super stable trimer (Cat. No. SPN-C52H9) is more than 90% verified by SDS-PAGE under reducing (R) condition. The molecular weight was around 550-660 kDa confirmed by SEC-MALS. The particles are similar in size and appearance to SARS-CoV-2 trimers reported in published literature verified by negative stain electron micrography.
Protocol
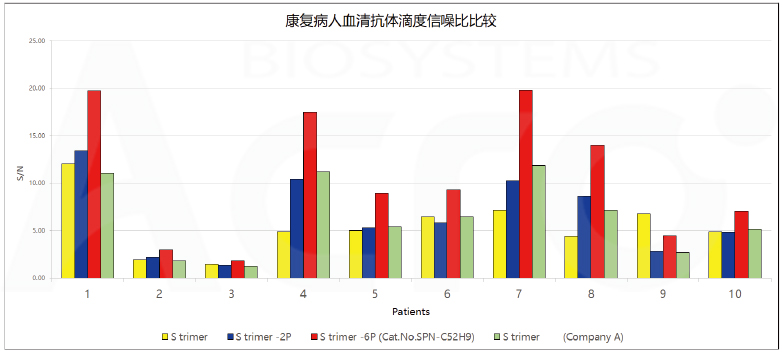
用不同的SARS-CoV-2 S protein检测康复病人血清,其中SARS-CoV-2 S protein, His Tag, Super stable trimer (Cat. No. SPN-C52H9)信噪比较高。
Protocol
Authors: Sasisekharan, Varun et al.
Journal: Proc Natl Acad Sci U S A 2021
Cited Product: SPD-C52H3 ,NUN-C5227
Application: ELISA
Authors: Esparza, Thomas J et al.
Journal: Scientific reports 2020
Cited Product: S1N-C5255,AC2-H52H8,SPD-C52H3,SPD-C52H3, SPD-C82E9,AC2-H82E6,SPD-S52H7,SPD-S52H4
Application: Immunization, Competitive Immunopanning, SPR & Binding Assay & Phage Display Clone Screening, BLI, Binding Assay
Antibody Signature Induced by SARS-CoV-2 Spike Protein Immunogens in Rabbits
Authors: Ravichandran S, Coyle EM, Klenow L, et al.
Journal: Sci Transl Med 2020
Cited Product: AC2-H52H8
Application: SPR
Antibody-like proteins that capture and neutralize SARS-CoV-2
Authors: Kondo T, Iwatani Y, Matsuoka K, et al.
Journal: Science advances 2020
Cited Product: S1N-S52H5
Application: ELISA
Binding of the SARS-CoV-2 Spike Protein to Glycans
Authors: Wei Hao,et al
Journal: BioRxiv (preprint) 2020
Cited Product: S1N-C52H3
Application: glycan microarray
Authors: Yan Lou. et al
Journal: BioRxiv (preprint) 2020
Cited Product: SPD-S52H4,SPD-S52H7,SPD-S52H8
Application: BLI,ELISA
Authors: Tyler N Starr, Allison J Greaney , Sarah K Hilton, et al.
Journal: BioRxiv (preprint) 2020
Cited Product: AC2-H82E6
Application: Flow cytometry
Flow-Mediated Susceptibility and Molecular Response of Cerebral Endothelia to SARS-CoV-2 Infection
Authors: Kaneko N, Satta S, Komuro Y, et al.
Journal: Stroke 2020
Cited Product: S1N-C82E8
Application: ELISA
HDL-scavenger receptor B type 1 facilitates SARS-CoV-2 entry
Authors: Wei C, Wan L, Yan Q, et al.
Journal: Nature metabolism 2020
Cited Product: SPN-C52H9,S1N-C52H3,S2N-C52H5,SPD-C52H3
Application: SPR & FACS & Confocal microscopy
Human Hematopoietic Stem, Progenitor, and Immune Cells Respond Ex Vivo to SARS-CoV-2 Spike Protein
Authors: Ropa, James et al.
Journal: Stem cell reviews and reports 2020
Cited Product: SPN-C52H8(该产品已下线。我们有质量更优的相似产品 SPN-C52H9 在线销售,欢迎点击了解!)
Application: Colony Forming Unit (CFU)
Immune responses to SARS-CoV-2 in three children of parents with symptomatic COVID-19
Authors: Tosif S, Neeland MR, Sutton P, et al.
Journal: Nature communications 2020
Cited Product: S1N-S52H5,S2N-C52H5,S1N-C52H3
Application: ELISA\FACS
Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults
Authors: Mulligan, Mark J et al.
Journal: Nature 2020
Cited Product: SPD-C82E9
Application: Immunogenicity assessments
SARS-CoV-2 exposure, symptoms and seroprevalence in healthcare workers in Sweden
Authors: Rudberg AS, Havervall S, Månberg A, et al.
Journal: Nat Commun 2020
Cited Product: NUN-C5227
Application: Luminex
Authors: Luetkens T, Metcalf R, Planelles V, et al.
Journal: Blood Adv 2020
Cited Product: S1N-C52H3
Application: ELISA